التحديات الطبية والعلمية أمام عمليات زرع الأعضاء المغايرة

لنتخيل أن أحد المرضى يحتاج لعملية زرع أعضاء، ولنقل أنه يحتاج إلى زرع قلب. في المستقبل القريب قد يتمكن أحد الخنازير التي يتم تربيتها بشكل خاص ويحمل جينات بشرية، من تقديم القلب للمريض. هذا هو الأمل الذي تعطينا إياه عمليات زراعة الأعضاء المغايرة. إن مصطلح زراعة الأعضاء المغايرة يشير إلى عمليات نقل الخلايا والأنسجة والأعضاء الحيوانية إلى الإنسان. في الحقيقة ليست هذه العمليات بالجديدة، فقد استخدمت صمامات القلب لدى الخنازير لسنوات عديدة دون ظهور نتائج سيئة. لكن الصمامات نسيج خامل بالأساس ونادرا ما تؤدي للرفض المناعي. هنالك حاليا حماس ملحوظ باعتبار أن زراعة الأنسجة الحيوانية الحية قد يصبح قريبا خيارا علاجيا عمليا. بالرغم من أن هذا الحماس يقابله قلق حول مخاطر حدوث عدوى جديدة من منشأ حيواني لدى متلقي الزرع. سنناقش في هذا المقال إمكانيات ومشاكل زراعة الأعضاء المغايرة وسنشرح سبب الشك بمستقبل هذه العمليات.
الحاجة للأعضاء
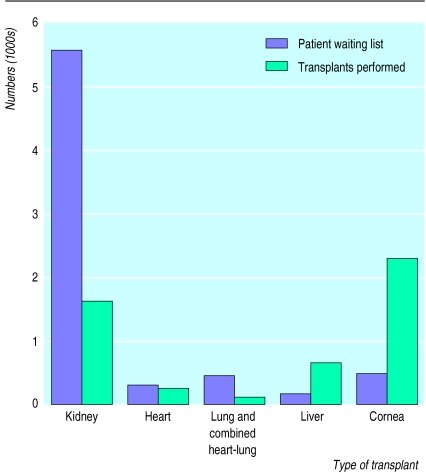
يوضح الرسم البياني التالي حالة عدم التوازن بين الحاجة للأعضاء ووفرتها، والانتظار الأكبر حتى الآن لصالح عمليات زرع الكلى. ستستمر الحاجة للمتبرعين بالأعضاء بالارتفاع مع ازدياد المرضى وازدياد الأمراض التي تحتاج للعلاج بواسطة عمليات الزرع. فحتى لو تم تبني سياسات اختيار عدم القبول (وهي السياسة التي يفترض فيها موافقة معطي العضو ما لم يذكر خلاف ذلك) فإن ما يتوفر من أعضاء وأنسجة لا يمكن أن يتناسب أبدا مع الحاجة للأعضاء، فهل ستسد الطعوم المغايرة هذه الفجوة؟
البحث عن الحيوان المناسب
من وجهة نظر فيزيولوجية، وبالنظر لقضية التحمل المناعي للطعوم المزروعة، فإن قرود العالم القديم والسعادين هما أكثر المصادر الواعدة للأنسجة. لكن، لكي نوفر حيوانات غير مصابة بفيروسات ممرضة للبشر، يجب توليد صغار القردة بعمليات قيصرية ومن ثم تربيتها بمعزل عن القردة الأخرى. هذا ما يثير مخاوف أخلاقية ليس لأننا نستخدم أقربائنا كمزارع للأنسجة والأعضاء فقط، بل لأننا نحرم الحيوانات الرضع من رعاية الوالدين ومن التطور السلوكي الهام جدا بالنسبة لجميع الرئيسيات.
اليوم، تعتبر الخنازير الحيوانات الوحيدة التي ينظر إليها بجدية مصدرا مستقبليا للأعضاء، بالرغم من وجود بعض الأمل بالمجترات وحتى بالكنغر. تنمو الخنازير وتصل لأحجام مناسبة بسرعة، وتنتج كميات كبيرة من الفضلات، كما يمكن تربيتها ضمن ظروف خاصة خالية من العوامل الممرضة. من الممكن أيضا تعديلها وراثيا لإنتاج أعضاء أقل عرضة للرفض المناعي عند زرعها في البشر. تستثمر العديد من شركات التكنولوجيا الحيوية ملايين الباوندات في تطوير خنازير معدلة وراثيا.
تبدو القضايا الأخلاقية عند استخدام الخنازير أقل أهمية مقارنةً باستخدام أحد أنواع الرئيسيات. فبعد كل شيء لطالما دجنت الخنازير منذ آلاف السنين، وربيت ثم ذبحت بصورة روتينية خدمةً للاستهلاك البشري، كما أن الاستخدام الطبي لصمامات قلب الخنزير لم يثر اعتراضات جادة من قبل الأديان التي ترفض استهلاك لحم الخنزير. لقد أصبحت الفئران المعدلة وراثيا شائعة الاستخدام في الأبحاث الطبية، ولا تختلف الخنازير المعدلة وراثيا عنها من حيث المبدأ أو الممارسة. فما هي المشكلات الطبية التي تواجه زرع أعضاء الخنازير عند البشر؟
إعلان
إليكم ثلاث أنواع من هذه المشاكل، فيزيولوجية، ومناعية ومكروبيولوجية.
هل ستعمل أنسجة الخنازير عند البشر؟
لم تكتشف جميع المشاكل الفيزيولوجية بعد. لقد استخدم أنسولين الخنزير لسنوات عديدة، فإذا زرعت خلايا جزر لانغرهانس الخنزيرية بنجاح قد تقوم بوظيفتها الصحيحة عند مرضى السكري المعتمد على الأنسولين. وبالمثل، ينبغي أن تكون قلوب الخنازير مناسبة بالرغم من حاجة الإنسان لضخ الدم إلى الأعلى ليصل للدماغ. ولكن، هل ستستجيب كلى الخنازير بتركيبتها ووظائفها المختلفة عن كلى الإنسان للإشارات البشرية المدرة للبول بشكل مناسب؟
إضافةً لوظيفة طرح البول، تصنع الكلى هرمون الإيرثروبيوتين الأساسي في عملية تنظيم إنتاج الكريات الحمراء والمساهمة في نضجها. لا يعمل إيرثروبيوتين الخنزير عند البشر لأن مستقبلاته الموجودة على سطح سلائف الكريات الحمراء في نقي العظام لا تتعرف على نسخة الهرمون الخنزيري. بالتالي فإن المرضى الذين يزرعون كلى خنازير بحاجة إلى العلاج بالإيرثروبيوتين البشري المأشوب.
لربما هنالك الكثير من الإشارات الفيزيولوجية الأخرى غير المتوافقة بين الخنازير والبشر، كتلك العوامل التي تتحكم بوظيفة نقي العظم والكبد. حتى الآن، لا نعرف ما هي الأنسجة التي ستعمل بصورة ملائمة ضمن بيئة الأنواع المتضاربة. قد توفر تجارب زرع أنسجة الخنازير عند القرود –كبديل عن البشر- مؤشرا للعقابيل محتملة الحدوث.
التحديات أمام البقاء الطويل للطعم المزروع
إن المشاكل المناعية التي تهدد بقاء الطعم المغاير أكبر من تلك التي تحدث في الطعم الخيفي –أي الزرع البشري من متبرع غير متطابق- لأن الطعم المزروع يدمر بواسطة ثلاث آليات: الرفض الحاد وفوق الحاد والرفض المتواسط بالخلايا.
الرفض فوق الحاد
هو تحلل متواسط بعناصر المتممة، يصيب الخلايا المبطنة للأوعية في عضو المعطي. إن الأضداد البشرية الطبيعية لأجزاء سكر Galα الأجنبية الموجودة على الخلايا البطانية للخنازير قادرة على جذب عناصر المتممة وتدمير الأوعية الدموية بغضون دقائق من التعرض لدم الإنسان. هذه الآلية مشابهة لما يحدث في انحلال الكريات الحمراء عند تنافر زمر ABO أو Rh بعد نقل الدم غير المتطابق. من الممكن كبح هذه الآلية بواسطة التعبير عن بروتينات المتممة البشرية المعدلة عند خنازير معدلة وراثيا. لا يتضمن الرفض فوق الحاد الخلايا التائية لذا فهو لا يشكل عائقا بالنسبة للطعوم غير الوعائية أو الطعوم الخيفية البشرية.
الرفض الوعائي الحاد
وهو تنشيط موضعي لاستجابات التهابية تؤدي لتشكيل خثرة صفيحات دموية وارتشاح الكريات البيضاء ضمن الأوعية الشعرية لأعضاء المعطي. يطلق عليه أيضاً اسم رفض الطعم المغاير المتأخر فهو يؤثر على أوعية العضو المزروع خلال 3-5 أيام. تشبه آلية الرفض هذه الآلية السابقة. فهي تنتج بشكل أساسي عن أضداد αGal الموجودة بشكل طبيعي في دم الإنسان قبل التعرض للعضو الأجنبي المزروع. يمكن كبح هذه الآلية بنفس الطريقة أيضاً. لا يشكل الرفض الوعائي الحاد عائقاً بالنسبة للطعوم غير الوعائية أو الطعوم الخيفية البشرية.
الرفض المتواسط بالخلايا
يتم هنا التعرف على المستضدات الموجودة على سطح خلايا الطعم كجسم أجنبي، وبالتالي تهاجمها الخلايا اللمفاوية التائية السامة. نظرا لكون هذه الاستجابة المناعية تبدأ من جديد، يحدث الرفض بعد أسبوع حتى أسبوعين من الزرع. وكما هو حال الطعم الخيفي البشري، يمكن كبح الرفض الخلوي للأجسام الأجنبية جزئيا باستعمال الأدوية المثبطة للمناعة كالستيروئيدات والسيكلوسبورين A.
الوقاية من الرفض الحاد
يتشابه البشر مع السعادين وقردة العالم القديم (ولكن على عكس الخنازير) في أنهم يفتقدون للمستضد السكري غالاكتوز- (1-3)α غالاكتوز (αGal). نظرا لكون العديد من الجراثيم المعوية تعبر عن αGal، يملك جميع البشر أضداد له، وهذه الأضداد ستلتصق ببطانة الأوعية الدموية للطعوم المغايرة المأخوذة من الخنازير. تتمثل إحدى الطرق التي تمنع حدوث الرفض فوق الحاد والرفض الوعائي الحاد في تربية خنازير تشبه البشر في افتقارها لإنزيم α(1-3) غالاكتوزيل ترانسفيراز المسؤول عن صنع المستضد الأجنبي الرئيسي αGal. مع ذلك، هذا النوع من “الإقصاء” لجينات محددة في الخنازير ليس بمتناول أيدينا حتى الآن.
إحدى المقاربات البديلة التي يمكن استخدامها تتمثل في تربية خنازير معدلة وراثياً قادرة على تركيب سكر منافس مثل α فوكوز، أو أنها تمتلك جينات بشرية لبروتينات الأغشية الخلوية مثل CD55(DAF)، CD46(MCP) أو CD59، وهذا يثبط شلال الأحداث التي يطلقها تفعيل عناصر المتممة البشري والتي تنتهي بحدوث الرفض الحاد. يزعم أن القلوب المزروعة من مثل هذه الخنازير تبقى لفترة أطول بكثير (تصل إلى 40 يوم) مقارنة بقلوب الخنازير الاعتيادية وذلك عند الزرع في القرود المثبطة مناعيا. فحتى لو حصل رفض مناعي للطعوم المغايرة في النهاية، ستفيدنا هذه الطعوم بوصفها “أعضاء مؤقتة” إلى حين توفر عضو بشري للزرع. بأية حال، ذلك سيزيد حتما من الحاجة للأعضاء البشرية.
إن أهمية الرفض الحاد والرفض فوق الحاد تقل عند زرع الخلايا والأنسجة المغايرة التي لا تتطلب وجود أوعية دموية سليمة. هذا هو السبب في تقدم عملية زرع الأعضاء في نطاق الأمراض التي لم تعالج حتى الآن، كآفات الدماغ التنكسية والسكري. لقد أجريت تجارب سريرية من المرحلة الأولى باستخدام نسيجين من الخنازير. الأول هو نسيج جزر لانغرهانس واستخدم لعلاج السكري. والثاني هو خلايا الدماغ الجنينية التي تفرز عوامل نمو عصبية قد توقف العمليات التنكسية في الدماغ، وذلك لعلاج داء باركنسون وداء رقص هنتنغتون.
الرفض المتواسط بالخلايا
إن آلية الرفض هذه مشابهة للرفض الذي يحدث في حالة الزرع الخيفي (عدم تطابق لجزيئات HLA المزروعة). إن الرفض المتواسط بالخلايا يلعب دوراً أساسياً في التعرف على العدوى الفيروسية. تستمر بعض الفيروسات الشائعة في الوجود داخل أجسادنا مدى الحياة، مثل الفيروس المضخم للخلايا CMV. ولكنها نادرا ما تسبب لنا الضرر في ظل وجود الخلايا التائية التي تتحكم بها بصورة دائمة. مع ذلك، يمكن أن تصبح هذه الفيروسات قاتلة عند مريض الإيدز ومتلقي الزرع المثبط مناعيًا. قد يساعد العلاج الوقائي المضاد للفيروسات في السيطرة على العدوى، لكننا لا نستطيع أن نؤكد حتى الآن ما إذا كان متلقي الزرع بحاجة علاج دوائي مثبط للمناعة مدى الحياة، وبالتالي ما إذا كان عرضة لخطر العدوى بشكل دائم أم لا.
هل تشكل فيروسات الخنازير خطراً على الإنسان
يجادل بعض مؤيدي زراعة الأعضاء المغايرة بأن الخنازير قد عاشت جنبا إلى جنب مع البشر لفترة طويلة جدا، وبالتالي فقد التقط البشر منها كل الجراثيم القادرة على إصابتهم بالعدوى. لكن زرع الأعضاء سيتيح انتقالا أسهل بكثير لفيروسات الحيوانات. أولا، بسبب كسر الحواجز المادية الدفاعية عندما توضع أنسجة الخنازير داخل جسد الإنسان. وثانيا، بسبب التثبيط المناعي اللازم للوقاية من رفض الطعم المزروع، مما يساعد على انتشار الفيروس وتكيفه مع بيئة المضيف الجديد. أما ثالثا، فمن الممكن للجينات البشرية الموجودة في الخنازير المعدلة وراثيا أن تعزز تكيفا مسبقا للفيروسات الحيوانية مع البيئة الحاضنة البشرية.
قد لا يتم الكشف عن فيروسات الخنازير إذا لم تسبب المرض للخنازير. على سبيل المثال، اكتشف فيروس الكاليسي الخاص بالخنازير والمرتبط ارتباطا وثيقا بفيروس التهاب الكبد الوبائي البشري، منذ سنة واحدة فقط. قد لا يسبب هذا الفيروس ضررا لدى الخنازير، لكنه بالتأكيد ممرض للبشر. تماما كفيروس الهربس B الذي لا يصيب قرود المكّاك بما هو أسوأ من قرحات البرد، ولكنه في المقابل يسبب التهاب دماغ قاتل عند البشر.
إن الخنازير المهيأة عن طريق التعديل الوراثي والتي تهدف للسماح بمدة بقاء طويلة للأعضاء المأخوذة كطعوم، تسمح لفيروسات الخنازير بإصابة البشر بسهولة أكبر. يمكن للبروتينات البشرية الموجودة على سطح خلايا الخنازير المعدلة وراثيا أن تعمل كمستقبلات فيروسية أيضا. فمثلا يعمل بروتين CD55 كمستقبل لفيروس كوكساكي B وفيروس الإيكو البشري (القريب من فيروس شلل الأطفال)، وهذان الفيروسان يسببان التهاب عضلية القلب. ويعمل بروتين CD46 كمستقبل لفيروس الحصبة، ولهذا فمن الممكن أن تتكيف الفيروسات الحصبية عند الحيوانات (مثل فيروس السل وفيروس الطاعون البقري) بشكل مسبق مع بيئة البشر وتصبح جاهزة للعدوى.
على أية حال، يمكن للفيروسات الحصبية أن تقفز عبر الأنواع. لقد علمنا بهذه الفكرة عند موت طبيب بيطري في أستراليا بعد تشريح جثة حصان، والذي كان بدوره قد أصيب بالفيروس من أحد خفاشيات الفاكهة. لقد انتشر بالفعل أحد الفيروسات المميزة من الخفافيش إلى الخنازير ومن ثم أثر على البشر المتماسين مع هذه الخنازير. لذا ينبغي أن نكون حذرين لكيلا نمد يد المساعدة للفيروسات عن طريق تربية الحيوانات التي تمتلك مستقبلات سطح خلية بشرية.
هنالك طريقة أخرى قد تؤدي فيها الخنازير المعدلة وراثياً إلى زيادة مخاطر الزرع المغاير. ستصبح الفيروسات التي تمتلك غلافا شحميا مشتقا من أغشية الخلايا المضيفة لها والتي تتبرعم منها، أقل عرضةً للتثبيط بواسطة عناصر المتممة البشرية. وهنا يصبح بالإمكان تحطيم ما يعتبر آلية دفاعية طبيعية ضد العدوى بالفيروسات حيوانية المنشأ، من خلال محاولة إطالة عمر الطعم الغيري المزروع عند البشر.
ستصبح هذه الحجج أكاديمية إذا ضمنا عدم وجود فيروسات الخنازير في القطعان المعدلة وراثيا والمهيأة لاستخدامها في زرع الأعضاء. سنقصي فيروسات عديدة عند تربية خنازير خالية من عوامل ممرضة محددة، ولكن يستحيل المسح بحثا عن فيروسات لم تكتشف بعد. علاوة على ذلك تحتوي الخنازير على جينومات داخلية المنشأ لفيروسات قهقرية. وهذه الجينومات تورّث صفاتًا مندلية في DNA الصبغيات الطبيعية عند الخنازير، وبالتالي فمن المستحيل القضاء عليها. يمكن تنشيط هذه السلاسل الفيروسية في DNA المضيف وإنتاج فيروسات ممرضة قريبة من فيروسات اللوكيميا عند الفئران، القطط وقرود الجيبون، وقريبة أيضاً من فيروس HIV.
وصلنا تقرير في العام الماضي يفيد بأن اثنين من ثلاثة فيروسات قهقرية داخلية المنشأ في الخنازير، قد أصابت الخلايا البشرية في المزارع الخلوية. تنطلق هذه الفيروسات القهقرية التي لها نطاق مضيف بشري محتمل، من الخلايا اللمفاوية الطبيعية والخلايا البطانية المأخوذة من خنازير سليمة. قادت النتائج التي توصلنا إليها الخبير في مناعة رفض الطعوم المغايرة، فريتز باخ بالدعوة إلى التوقف عن إجراء عمليات زرع الأعضاء المغايرة عند الإنسان إلى أن يعرف ما إذا كانت الفيروسات القهقرية قادرة على أن تصيب الرئيسيات وتتسبب بالمرض لديها.
الموازنة بين الفوائد والمخاطر
أجريت استقصاءات على المرضى القليلين الذين زرعوا جزر لانغرهانس خنزيرية وخلايا دماغية، وعلى اثنين من مرضى الغسيل الكلوي الذين غسلوا كلاهم خارج الجسم مؤقتاً عن طريق استعمال كلى الخنازير. لم تظهر هذه الاستقصاءات أي دليل على وجود عدوى بالفيروسات القهقرية. إذا أعطت الاختبارات التي ستجرى على أفراد معرضين لنفس الظروف نتائج مماثلة، فقد يبدو منع عمليات زراعة الأعضاء المغايرة مقيِدا بصورة غير ضرورية. قد لا يصبح الانمساخ مقتصرا على الأساطير أو على كوابيس كافكا.
مع ذلك، هنالك سبب محدد لحرصنا الاستثنائي. بينما قد يكون التوازن بين خطر العدوى بفيروسات الخنزير وخطر الموت المحتمل بسبب عدم توفر عضو بشري للزرع، مقبولا عند متلقي الزرع، فإن الخطر بعيد المدى والمنطقي قد يجلبه هذا المريض بخلقه لوباء بشري جديد تماما، يقع في حسبان مختلف بالكامل. لذا ينبغي للقرارات المستقبلية المتعلقة بزراعة الأعضاء المغايرة أن تأخذ الصحة العامة بعين الاعتبار. لهذا قبلت وزارة الصحة البريطانية نصيحة لجنة كينيدي بإنشاء هيئة التنظيم المؤقتة لزرع الأعضاء المغايرة في المملكة المتحدة، وتحميلها مسؤولية مراجعة التطورات والسماح بإجراء تجارب سريرية. قررت إدارة الغذاء والدواء الأمريكية مؤخرا أنه لا ينبغي ترك تجارب زرع الأعضاء المغايرة لتقدير لجان الأخلاقيات المحلية. وهي الآن بصدد وضع إرشادات جديدة لذلك.
لقد أصبح من المقبول الآن المراقبة طويلة الأمد لمتلقي العضو المغاير. لكن الحاجة لمراقبة مخالطي المريض في حال أصابته عدوى حيوانية المنشأ، تثير مشاكل أخلاقية وعملية. فما الذي يجبر مرضى كهؤلاء على أن يقدموا لنا معلومات كاملة؟ وكيف ستتم مراقبة المخالطين؟ قد يتعين على الجراحين التعلم من عيادات الأمراض المنقولة بالجنس.
بوصفه إجراء طبي، قد يستفيد المريض من عملية زرع العضو المغاير، لكنه يهدد بحدوث ضرر للمجتمع. يقال أن هذه المفارقة تطرح قضية أخلاقية جديدة، لكنها ذات طابع مألوف. إذا أقنعتك بأن المتابعة بزراعة الأعضاء المغايرة تصرف أرعن، فتذكر فقط أن تقديم الفائدة الفورية على حساب تكلفة بعيدة الأمد يعد ممارسة يومية لأطباء المشافي عند إفراطهم في وصف الصادات الحيوية. بينما يشفى المريض عادةً، ما يهدد صحتنا المستقبلية هو عالم مليء بجراثيم عديدة مقاومة للصادات. ربما لا يختلف قصر النظر عند مجري عملية الزرع المغاير عن قصر نظر بقيتنا.
التطلع إلى المستقبل
في المستقبل، يمكننا تصور زيادة استخدام العلاجات “خارج الجسم الحي” باستعمال الخلايا الحية. وهنا ستبدأ الأنسجة البشرية المزروعة بالتنافس مع المصادر الحيوانية للأعضاء. لا يزال هنالك نقاش حول الحفظ الروتيني للخلايا الجذعية المأخوذة من الحبل السري. فقد تستخدم هذه الخلايا لاحقاً لعلاج نفس الشخص الذي أخذت منه. بالإضافة لذلك، قد سمح الاستنساخ من الخلايا الناضجة –كما حدث مع النعجة دولي- بتجديد الأنسجة البشرية الوظيفية. وفي نهاية المطاف، يسمح بتجدد الأعضاء بدءًا من الخلايا الجسدية. مع التطور في إعادة برمجة التمايز الخلوي، قد يصبح المريض نفسه متبرع بالطعم الذاتي مما يجعل الطعم المغاير بلا ضرورة. على أية حال، يرجح أن تكون هذا التطور في العلاج الخلوي أبعد من التطور في زرع الأعضاء المغايرة.
نرشح لك: هل سيتمكن الإنسان من تجديد أطرافه المبتورة يومًا ما؟
المصدر
إعلان
