علاج التقدم في السن وعلم الخلود

لقد أكَّدت، في السّابق، عدم وجود أدوية حقيقيّة مضادّة للشّيخوخة بعد. وفي هذا المقال التخميني، أبحث في إمكانيّة تطوّر علم الشيخوخة بهدف ابتكار علاجات حقيقيّة مضادّة لها، لا تقتصر فقط على إطالة عمر الإنسان وتأخير الشّيخوخة البشريّة؛ وإنَّما قد تعالج الشيخوخة في نهاية المطاف.
1. خارطة طريق لابتكار علاج للشّيخوخة:
“لا يمكن لمعضلة ما الصّمود تحت وطأة التّفكير المستمرّ.” فولتير
إنَّ ما ألقي له بالًا، كما ذكرت سابقًا، هو سبر أغوار عملية التقدم في السن من أجل المنفعة البشريّة، وذلك لتطوير تدخّلات الطب الحيوي الّتي من شأنها أن تُؤخّر الشيخوخة لدى النّاس وتُحسّن صحّتهم. لا شكّ أنَّ علاج الشيخوخة مهمّة جبارة؛ إذ ما زالت الأمراض الرئيسية المرتبطة بالعمر نحو السرطان وأمراض القلب والأمراض العصبيّة غير قابلة للشفاء، ذلك أن الجميع يصبحون واهنين مع تقدّمهم في السن. من الممكن أنّ الجينات المعروفة ذات الصّلة بالشيخوخة والتدخّلات الطبيّة لتمديد الحياة، نحو الحدّ من السّعرات الحراريّة مثلما جرت المناقشة في السّابق، يمكن أن توظّف لتطوير العلاجات المضادّة للشيخوخة.
إنَّ آفاق اكتشاف العقاقير في مجال الشيخوخة تعتبر واعدة للغاية، إلاَّ أنَّنا- وحتى في ظلّ أفضل السيناريوهات- يمكننا تطوير علاجات تحاكي عملية الحدّ من السّعرات الحراريّة وتأثيرات الجينات على الشيخوخة الّتي لُوحظت في النّماذج الحيّة، فإّنَّ مثل هذه العلاجات لن تعالج الشيخوخة ولن تُحسّن عمرنا جذريًّا. ولنضرب على ذلك مثلًا، القوارض الّتي يمكن تمديد عمرها الافتراضي بنسبة تصل إلى 50٪، كما وضّحنا في بحث آخر، وهي نتيجة كان من شأنها أن تكون استثنائيّة إذا كان ذلك ينطبق على البشر، ولكن لا تزال بعيدة عن علاج الشيخوخة.
لذلك، بينما يمكننا التّلاعب بالشّيخوخة داخل الأنظمة النموذجيّة، بما في ذلك الثدييّات، لا يزال هناك طريق طويل أمامنا. ومع ذلك، فإنّنا قد نكون على أعتاب ثورة في التكنولوجيا الحيويّة والطبيّة لننتقل من خلالها من مجرد مراقبين للطبيعة إلى مهندسين. إذًا، ما هي الأساليب العلمية الأكثر ملاءمة لعلاج الشيخوخة؟ وهل من الممكن حتى علاجها؟
بالنّظر إلى تعقيد عمليّة الشّيخوخة، شكّك الكثيرون فيما إذا كان علاج الشيخوخة أمرًا واقعيًّا حتّى ومع ذلك، ليس هناك أيّ سبب علميّ للتّسليم بعدم إمكانيّة علاجها ففي نهاية المطاف، لا ينتهك علاج الشيخوخة أيّ قانون من قوانين الفيزياء. توجد أسباب بسيطة تبعثنا على التّفاؤل، مثل حقيقة أنّنا نستطيع إرجاع بعض أشكال الشيخوخة الخلويّة إلى سابق عهدها في المختبر، بما في ذلك الخلايا البشريّة، عبر إنزيم التيلوميراز.
إعلان
من الممكن أيضًا تجديد الخميرة عن طريق تحويل عامل انتساخ واحد والأهمّ من ذلك، أنّ بعض الأنواع تعيش لفترة أطول بكثير من البشر، وحتى أنّ البعض منهم لا يشيخ. إذا تمكنت الطبيعة من حل معضلة الشيخوخة، فلا يوجد سبب للاعتقاد بأنّنا لا نستطيع القيام بالشّيء نفسه. وهذا يماثل اختراع آلات طيران أكثف من الهواء، والّتي كانت في الواقع مستوحاة جزئيًّا من الطّيور. وكما هو مُبيّن بالتّفصيل في بحث آخر، فإنّ الشيخوخة مِطْواعة بشكل مذهل ويمكن التّلاعب بها من خلال التّدخلات الجينيّة والبيئيّة. ولا شكّ أنّ إيقاف الشيخوخة أو عكسها أصعب بكثير من إبطائها، ولكنّه ليس أمرًا مستحيلًا. فما مدى صعوبة ذلك بالضّبط؟ آمل أن نتمكّن من اكتشاف ذلك في العقود المقبلة.
لسوء الحظّ، فإنّ معرفتنا الضّئيلة بآليات الشيخوخة تقف حجر عثرة أمام تطوير التدخلات الطبية الحقيقية لمكافحة الشيخوخة. وقد حاجّ آخرون بأننا لسنا بحاجة للإحاطة علمًا بكيفية اشتغال السيارة من أجل قيادتها، ولذا ربما لا نحتاج إلى تعلم كل شيء عن الشيخوخة من أجل علاجها. ومثلما بَيَّنا في موضع آخر، فأنا أقلّ تفاؤلًا؛ إذ أنّني أعتقد أنّ القياس الأفضل هو: عندما تتعطّل سيّارة ما، فإننا نحتاج إلى معرفة الكثير عن كيفيّة عملها لإصلاحها. ومثلما فصّلنا أدناه، أعتقد أنّنا بحاجة إلى إثراء معرفتنا ليس فقط بالشّيخوخة، وإنّما بالحياة نفسها من أجل التّدخل بشكل حاسم في مسألة الشيخوخة. لكن ما الذي نحتاج إلى معرفته بالضّبط؟ أعتقد أن هناك ثلاث مجالات عامّة يجب علينا معالجتها، باعتبار معالجة الشيخوخة هدفًا منشودًا وبناءً على الأنظمة النموذجيّة المتاحة، تتمثّل في:
1. توسيع معرفتنا بآليات الشيخوخة
2. تطوير فهم أعمق للبيولوجيا، وتحديدًا آلات دعم الحياة وتفاعلاتها (والتي يمكن اعتبارها الهدف الأوسع نطاقًا للنقطة المذكورة أعلاه)
3.ابتكار طرق جديدة لتعديل العمليّات البيولوجيّة داخل الجسم الحيّ
2. سبر أغوار عمليّة الشيخوخة:
تتباين الآراء حول عمليّة الشّيخوخة، ويمكن توظيف العديد من الاستراتيجيات المختلفة لدراستها، لكنّي أعتقد أنّ أهمّ سؤالين في علم الشيخوخة هما: 1- ما الّذي يتحّكم في معدّل الشيخوخة بين الثدييات؟ هذا يمكن أن يشير إلى الاختلافات الوراثية بين الأفراد (مثلًا أشخاص مختلفون)، لكن السّؤال الرّئيسي هو: لماذا يشيخ الفأر أسرع بثلاثين مرّة من الإنسان؟ 2- ما هي التغيرات التي تطرأ على الشّخص من سنّ 30 إلى 70 سنة حتّى تزيد فرصة الموت بقرابة 30 مرّة؟
إنّ معالجة هذين السّؤالين من شأنها أن تمنحنا المعرفة الأساسيّة للبدء في التفكير في العلاجات ضدّ عمليّة الشّيخوخة ككلّ. سنكتشف، من خلال معرفة الآليات الّتي تتحّكم في وتيرة الوهن المرتبط بالعمر، المسارات الّتي نحتاج إلى استهدافها لتأخير الشيخوخة. وبطريقة مماثلة، قد نجد آليات يمكن أن نستهدفها عن طريق العلاجات من خلال تحديد الاختلافات بين الشّباب وكبار السنّ الّتي تزيد من معدّل الوفيّات بشكل ملحوظ، حتّى وإن كان التّمييز بين أسباب وآثار الشيخوخة سيستمرّ في كونه أمرًا عسيرًا.
في الوقت الرّاهن، لا نعرف سوى القليل جدًّا عن كلا السّؤالين الأوّل والثّاني. نحن نستمدّ العلم القليل الذي نعرفه عن التغيرات التي يتحمّلها النّاس مع تقدّمهم في السنّ من الدّراسات على مستوى الأنسجة والأعضاء، مثلما بيّنا من قبل. بمعنى، نحن نعرف تغيّرات معيّنة مرتبطة بالسنّ والتّراجع الوظيفي، لكنّنا لا ندري لماذا يحدث ذلك، ما هي الآليات الكامنة وراء هذه الأحداث أو كيف تؤثّر التغيّرات على مستويات بيولوجية مختلفة (نحو الجزيئية، الخلوية، النسيج،… إلخ.) على بعضها بعض.
لقد نمت معرفتنا بعمليّة الشيخوخة على المستوى الخلوي والجيني في العقود الأخيرة، ولكنّها ما زالت محدودةً ومثيرةً للجدل. على سبيل المثال، تظل معرفتنا بدور التغييرات الخلوية في الشيخوخة موضوعًا مثيرًا للجدل. فيما يتعلق بالسّؤال الأوّل، فقد أُحرز تقدّمًا على مستوى الكائنات النموذجيّة في فهم الجينات المنظّمة للشّيخوخة داخل الأنواع الحيّة.
تبيّن في السّنوات الأخيرة أنّ المئات من الجينات تعدّل الشيخوخة في الأنظمة النموذجيّة، رغم أنّه لا يزال هناك الكثير من العمل لفهم كيفيّة تفاعلها مع بعضها البعض، وكيف تعمل بشكل عام للتّأثير على النّمط الظاهريّ للشّيخوخة.
لتسهيل هذه الدراسات، طور مختبرنا قاعدة بيانات GenAge للجينات المتعلّقة بالشّيخوخة. ومع ذلك، فإنّ تأثيرات هذه الجينات ذات الصّلة بالشّيخوخة متواضعة مقارنة باختلافات الأنواع الحية في الشيخوخة، والتي لا نعرف عنها شيئًا تقريبًا فيما يتعلّق بالآليات. تُشير بعض الأدلّة من علم الجينوم المُقارن في الواقع إلى أنّ الجينات التي تنظّم الشّيخوخة داخل الأنواع الحيّة، مثل المحورGH/IGF-1 (هرمون النموّ/ عامل النموّ شبيه الأنسولين-1)، غير متأثرة بتطوير الجينات تمامًا، ومن المستبعد أن تُحدّد الأنواع الحيّة في الشيخوخة.
ولا عجب أنا نصبّ التّركيز داخل مختبري إلى حد كبير على معالجة السّؤالين الأوّل والثّاني. على سبيل المثال، قمنا بتطوير أطلس رقميّ للشّيخوخة للمساعدة في معالجة السّؤال الثّاني. عمومًا، أعتقد أنّ علماء الشّيخوخة يجب أن يبدؤوا أوّلًا بالإجابة عن هذه الأسئلة قبل أن نتمكّن من ابتكار علاجات أقوى ضدّ الشيخوخة.
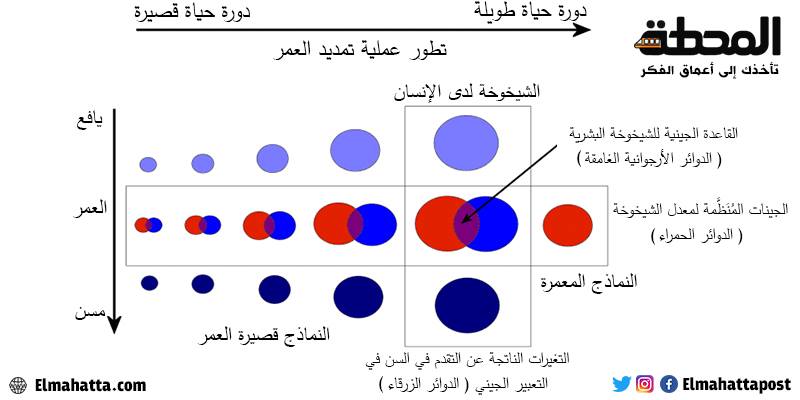
الاختلاف هو الأساس لدراسة أيّ ظاهرة من الظّواهر، وعمليّة الشيخوخة ليست استثناءً. من جهة، قد نستخدم منهجًا بيولوجيًّا مقارنًا لفهم سبب اختلاف وتيرة الشيخوخة عند الأنواع الحيّة المتنوّعة (وبدرجة أقلّ دراسة الاختلافات في طول العمر بين الأفراد من نفس النّوع). من جهة أخرى، وبصورة موازية، قد ندرس التغيرات التي يتكبّدها جسم الانسان أو الحيوانات مع تقدّمهم في السّن.
تسهّل مجموعة متنوّعة من التّكنولوجيا فائقة الأداء لدراسة الأحياء (الأوميكس) مثل هذه الدراسات. من خلال تسلسل الجيل التالي، يمكننا تعقّب مئات الجينوم وكذلك دراسة تعبير الآلاف من الجينات بينما يشيخ الإنسان أو الحيوانات. لاحظ كيف أنّ مساحة الدوائر تتناقص عندما ندرس الأنواع الحيّة بعيدًا أكثر فأكثر عن الإنسان، إذ من المتوقّع أن تكون الأنواع الحيّة التطوّرية البعيدة عن البشر أقلّ احتمالًا لمشاركة آليات الشّيخوخة ذات الصّلة بالبشر.
إنّ أحد الجوانب الهامّة للبحث في الشّيخوخة، والّتي يغضّ عنها أحيانًا الباحثون الطّرف بما في ذلك نفسي، هو أنّ بحثنا يجب أن يتعامل مع شيخوخة الإنسان. إنّ الشّيخوخة لدى الكائنات الحيّة النّموذجية لا صلة لها بالموضوع إذا لم تكن قابلة للتطبيق على البشر. قد تكون بعض آليات الشيخوخة الّتي حُدّدت في الكائنات الحيّة ذات صلة بشيخوخة الإنسان، في حين أنّ البعض الآخر قد لا يكون كذلك؛ ولكنّ التّمييز بين الاثنتين يكون مستحيلًا في كثير من الأحيان، كما ورد في بحث آخر. على هذا النّحو، ورغم أنّ الأنظمة النّموذجية ستظلّ قطعًا ذات أهميّة قصوى بالنّسبة للبحث عن الشّيخوخة، فمن الضّروري أن نحافظ على عقل متشكّك عند تحليل البيانات المتعلّقة بالكائنات الحيّة النّموذجية، وخاصّة النّماذج غير الثديية.
بمجرّد معرفة المزيد عن الآليات التي يجب استهدافها لأغراض علاجيّة، يمكننا النّظر في تطوير علاجات تؤدّي إلى تأخير أو إيقاف أو عكس عمليّة الشّيخوخة (الرّسم التّوضيحي 2). قد يُنظر إليه على أنّه أمر جزافيّ للنّظر في مثل هذه العلاجات الطّموحة لمكافحة الشيخوخة في الوقت الرّاهن، بما أنّنا لا نعرف الكثير عن التدخّلات الطبيّة التي ستكون ضرورية، ولكن هناك بعض الأفكار الموضّحة أدناه وفي بحث آخر. أنا متفائل لحقيقة أنّه عندما يعالج الباحثون السّؤالين المذكورين أعلاه، فإنّ هذا سيفتح الباب أمام تطوير علاجات حقيقيّة مضادّة للشّيخوخة قادرة على تمديد العمر بشكل جذريّ. ولكن كما هو مفصل أدناه، يجب وضع هذه التّطوّرات في سياق التّطوّرات الأخرى في علوم الحياة.
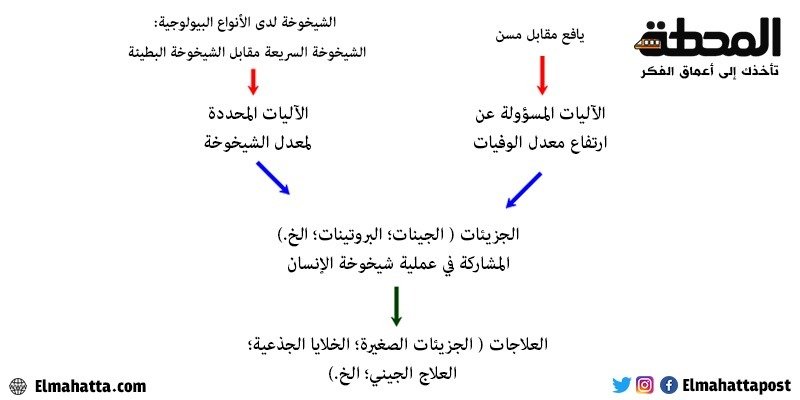
من جهة، يجب أن نحدد الأهداف العلاجيّة من خلال دراسة السّبب الّذي يكمن وراء صيرورتنا أوهن مع التّقدم في السن و/أو سبب تقدّمنا في السنّ الأبطأ مقارنةً بمعظم الثدييات الأخرى. ثمّ يجب علينا، من جهة أخرى، تطوير تكنولوجيات قادرة على استهداف الجزيئات أو الخلايا أو الأنسجة اللاّزمة لعكس الشيخوخة، كما فُصّل من قبل.
3. علم الجينوم ووعد البيولوجيا الرقميّة:
“الجنرال الّذي يظفر بالنّصر في المعركة هو الّذي يقوم بالعديد من الحسابات.” سان تزو من كتاب”فنّ الحرب”
إنّ واحدة من أهمّ المشاكل البيولوجية تكمن في عدم القدرة على التنبّؤ بها إلى حدّ كبير. على سبيل المثال، معدّل نجاح الأدوية في التّجارب السّريرية يمثّل 20٪ فقط، ويرجع السّبب في ذلك إلى أنّ البيولوجيا معقّدة جوهريًّا، وبالتّالي، حتّى مع اعتبار النّتائج قبل السّريرية الواعدة من ناحية الخلايا والكائنات النموذجيّة، فإنّ معظم العقاقير المختبرة على البشر لا تتفاعل وفق الطريقة الّتي يتنبّأ بها العلماء والأطبّاء، وغالبًا ما تكون لها آثار جانبيّة سلبيّة غير متوقّعة.
وبالمثل، لا تزال البيولوجيا الهندسية، حتّى في الكائنات العضويّة الدّنيا، محدودةً للغاية، ويرجع ذلك في معظم الأحيان إلى معرفتنا غير المكتملة للنّظم البيولوجيّة. ولذلك، من الضّروري أن نُكَوَّنَ فهمًا بيولوجيًّا أعمق بكثير من أجل تطوير التدخّلات الطبيّة المتعلّقة بالشّيخوخة، وكذلك الأمراض والعمليّات الأخرى. لحسن الحظ، قد تسمح لنا بعض التّقنيات النّاشئة بمواجهة تعقيد الحياة.
بشكل من الأشكال، فإنّ الجينوم البشري يحتوي على كل المعلومات التي نحتاج إلى معرفتها عن الشيخوخة، وقد يكمن سرّ الخلود في جينومات الحيوانات الّتي لا تشيخ. المشكلة هي أنّ السرّ مشفّر، وأنّ العديد من جوانب الجينوم تبقى لغزًا. على سبيل المثال، في الوقت الرّاهن، لم تُدرس نصف الجينات البشريّة التي تبلغ ما يقرب من 20.000 جيّدًا. بالإضافة إلى ذلك، لا تزال الطّبقات النّاشئة من تنظيم الجينات، مثل الميكرو رنا (microRNAs)، غير مستكشفة إلى حدّ بعيد. رغم ذلك، فإنّ الثّورة الجينية المستمرّة، وخاصّة تطوير تكنولوجيات التّسلسل في الجيل التّالي، تعِد بتحويل البيولوجيا إلى مسألة رياضيّة وتفكيك الجينوم البشريّ.
تتزايد قدرتنا على توليد البيانات المتعلّقة بأنماط الجينوم واسعة النّطاقبسرعة مذهلة، وأسرع حتى من زيادة الحواسيب في الطاقة. وهذا يؤدّي إلى النّموذج النّاشئ للبيولوجيا الرقميّة الّتي يتمُّ من خلالها التّعامل مع الأنظمة البيولوجيّة كنُظم معلومات يمكن دراستها من خلال مزيج من المقاربات المتعلّقة بالمعالجة الآليّة للمعلومات البيولوجيّة (المعلوماتيّة البيولوجية) والرّياضيّة.
تمسح اتّحادات واسعة النّطاق الأنماط الظّاهرية على القاعدة الجينوميّة الواسعة، وعلى سبيل المثال، تهدف الجهود المستمرّة إلى تطوير طفرات الفأر وتوصيفها عن جميع جينات تشفير البروتين.
توجد جهود أخرى واسعة النطاق، نحو موسوعة عناصر الحمض النّوويّ “ENCODE” الّتي تهدف إلى تحديد جميع العناصر الوظيفيّة في الجينوم البشريّ، ستزيد ممّا لا شكّ فيه من فهمنا للجينوم. إنّ هذه الجهود المشتركة تبشّر بآمال واسعة لزيادة قوّتنا التنبؤيّة في مجال الطبّ، وبالتّالي تقودنا إلى استهداف أدقّ للأنظمة البيولوجية، وذلك للحفاظ على الصّحة البشريّة ومكافحة الأمراض.
أنا على قناعة بأنّ علم الجينوم والمعلوماتيّة البيولوجيّة سوف تضطلع بدور رئيسي في فك لغز عمليّة الشّيخوخة وربّما سرّ الخلود. من المؤكّد أنّه يجب التّغلّب على هذه العقبات الرّئيسة. وقد تمّ تحديد تسلسل جينومات بعض الفيروسات المعيّنة منذ سنوات، وما زلنا لا نستطيع علاج الأمراض المرتبطة بها، مثلما نُوقش من قبل. إلى جانب ذلك، فإنّ الاختلافات الجينية الّتي تحدّد معدّل الشّيخوخة عبر الأنواع وداخلها من المحتمل أن تكون دقيقة للغاية. على سبيل المثال، لدى البشر والشّمبانزي نفس مجموعة الجينات، ويعتقد أنّ الاختلافات الطّفيفة في البروتينات أو في مناطق الانتساخ تُحدّد الفروق بين الشّمبانزي والبشر. وبالتّالي، من المتوقّع أيضًا أن تحدّد الاختلافات الجينيّة الدّقيقة معدّل الشّيخوخة، وسيكون العثور عليها في المليارات من الأزواج القاعديّة التي تشكّل الجينوم مهمّة جسيمة. لكن في النّهاية، يحمل الجينوم في طيّاته جميع الإجابات، كل ما يتعيّن علينا فعله هو توليد البيانات لطرح الأسئلة الصحيحة.

إذا استطعنا فهم العوامل الوراثيّة الّتي تحدّد معدّل الشّيخوخة بين الأنواع الحيّة المتشابهة، مثل الثدييات، فقد يكون من الممكن تطوير تدخّلات طبيّة تمدّد دورة حياة الإنسان إلى أبعد من ذلك. نذكر هنا اقتباسًا للسلي أورغل: “إنّ التطوّر أذكى ممّا أنت عليه”، لذلك فإنّ تحديد الخُدع الّتي يقوم بها التّطوّر لتمديد دورة الحياة قد يكون له تطبيقات بيولوجيّة طبيّة. وظّف آلان كار الخطوط الحيوانيّة في هذا الرّسم التّوضيحي.
4. مُكافحة الشيخوخة: الْمُضِيّ قُدُمًا:
“بحلول عام 2030، سيكون لدينا: أوّلًا، نموذجًا متكاملًا لجميع أنواع الخلايا البشريّة، ممّا يلغي الحاجة إلى العديد من التّجارب المخبريّة (عن طريق إجراء عمليّات المحاكاة بالكمبيوتر بدلًا من ذلك)؛ ثانيًا، خفض تكلفة إجراء تسلسل جيني كامل للكائنات البشرية إلى أقلّ من 1000 دولار لكلّ منهم؛ وثالثًا، فهرسة جميع الجينات المعنيّة بالشيخوخة. لذلك، يمكن أن تكون التّجارب السّريرية البشرية لتمديد الحياة قد رأت النّور بالفعل في هذا التّاريخ.” فرانسيس كولينز
ستكون دراسات السيليكون (التي تقوم على المحاكاة بالحاسوب) واحدة من المقاربات الرّئيسة لتحديد أسباب الشّيخوخة وتطوير التّدخلات البيولوجيّة الطبيّة. يجادل بعض أصحاب فلسفة الخلود بأنّ مفتاح حلّ شيخوخة الإنسان يكمن في أجهزة الكمبيوتر والذّكاء الاصطناعيّ وليس في علم الأحياء؛ أي بناء أجهزة كمبيوتر أكثر ذكاءً منّا قادرة على حلّ المشكلات التي لا يمكننا حلّها. أنا لست متحمّسًا جدًّا، ولكن أتفق أنّ حلّ مُعضلة الشيخوخة سوف يعتمد جزئيًّا على علم الأحياء الحسابي. إذا أدّى علم الجينوم والمعلوماتيّة البيولوجيّة إلى فهم أعمق لعلم الأحياء الموصوف أعلاه، سنكون قادرين على بناء نماذج حاسوبية للخلايا البشرية وتطوير التدخلات بشكل أفضل.
إنّ المجال النّاشئ لبيولوجيا الأنظمة، الذي يجمع بين النّمذجة والتكنولوجيات المرتبطة بالتخصّصات البيولوجية واسعة النطاق والمعلوماتية البيولوجية والتّجارب، يحمل في طيّاته وعدًا كبيرًا، حتّى وإن بقي الكثير من العمل لجعل النّماذج التنبؤية حقيقة .
في نهاية المطاف، فإنّ الهدف هو بناء نماذج من الأنظمة البيولوجية، بما في ذلك الشيخوخة، التي تكون دقيقة بما فيه الكفاية لخلق تنبؤات حول التّلاعب بمكوّنات النّظام (على سبيل المثال، أي استهداف جيني هو أكثر واعدية لتطوير الأدوية)، والتنبؤات حول التغيّرات المكانيّة والزّمنيّة داخل النظام، وكيف يمكن تعديلها بواسطة الأدوية والتّدخلات الأخرى،… إلخ. وفي الوقت الرّاهن، لا تزال الأنظمة والبيولوجيا التّركيبية في مرحلة مبكرة للغاية وتقتصر على النّماذج والدّوائر الجينية البسيطة جدًّا، ولكن بالنّظر إلى عقود قادمة، فإنّ إمكانية نمذجة عمليّة الشيخوخة كاملة وتحديد كيف يمكن تأخيرها، توقيفها، وحتّى عكسها موجودة بالتّأكيد.
“سأعيش أبد الدّهر أو أموت محاولًا.” مجهول
توجد أدلّة ملموسة على أنّ الشّيخوخة يمكن عكسها، ويبدو أنّ هذا هو الحال بالتّأكيد على المستوى الجزيئي والخلوي. فعلى مستوى الخلايا الجذعيّة، فإنّ عمليّة إعادة تجديد الذّات عن طريق منع بعض العوامل مُمكنة. وحقيقة أنّ عددًا من تغيّرات الشّيخوخة يبدو أنها بسبب مسارات الإشارات- مشجّعة، لأنّها تعني أنّه قد يكون من الممكن عكسها. على سبيل المثال، يبدو أنّ الشيخوخة في الخلايا التّائية تخضع للتّنظيم من خلال مسارات الإشارات الّتي يمكن عكسها. علاوةً على ذلك، يمكن للتّعبير الجيني القسري لدى الفئران لعامل انتساخ واحد أن يحفّز تجديد الغُدّة الصَعْتَرِيّة.
كما بيّنا في ورقة بحث أخرى، يمكن تجديد الخلايا من المُعمّرين (الذّين تجاوزوا القرن من العمر) وتحفيز تعدّد فاعليتها من خلال أربعة عوامل هناك عامل واحد (نانوغ) كافٍ لعكس تأثيرات الشيخوخة على بعض أنواع الخلايا الجذعيّة، يمكن أيضًا إعادة تنشيط الخلايا الجذعيّة المُكوّنة للدّم داخل الفئران عن طريق تحفيز الخلايا الجذعيّة مُتعدّدة الفاعلية، وتُوضّح مثل هذه الدراسات أنّه بالامكان إعادة ضبط ساعة الشيخوخة. وبطريقة مماثلة، هناك أدلّة على أنّ العوامل النّظاميّة مهمّة في عمليّة الشيخوخة، رغم أنّ التّأثيرات طويلة المدى (على سبيل المثال، تمديد العمر) لعكس العوامل النّظامية في الفئران مجهولة، فإنّ زرع مبايض شابّة في الفئران الطّاعنة في السن يزيد من عمرها زيادة طفيفة.
كشفت إحدى الدّراسات الّتي تستخدم بروتيوميات الدّم عن عامل محدّد يعكس تضخّم القلب المرتبط بالسّن لدى الفئران. إنّ كلًّا من العوامل الداخلية والخارجية للخلايا لها تأثير على تجديد العضلات، ويمكن لمستويات الدّم من الكيموكاين أيضًا أن تنظّم سلبًا تخلّق النّسيج العصبي. إذا جمعنا هذه النتائج بعضها ببعض، فسنجد أنّها تدفع إلى أنّه باكتساب المعلومات الصّحيحة قد يكون من الممكن عكس الشّيخوخة في العديد من الأنسجة. علاوةً على ذلك، ينبغي الإشارة إلى أنّه على الرّغم من أنّ مسارات التأشير تدفع الخلايا التّائية إلى الشيخوخة، فمن المحتمل أن تكون هذه العوامل ناتجةً عن عوامل تمهيديّة يكون التحكّم بها أصعب مثل تلف الحمض النووي.
لا شكّ في أنّني متفائل بشأن احتمال إطالة دورة حياتنا جذريًّا، لكنّني أُدرك أيضًا المشاكل العديدة التي ينطوي عليها الأمر. بينما أعتقد أن هناك عوامل وراثيّة تشكّل جوهرًا موحّدًا لشيخوخة الإنسان، فإنّه من المستحيل تحديد عدد الجينات المعنيّة. إنّ حقيقة عدم قدرة أيّ إنسان (أو ثديي) على تجنّب الشيخوخة بشكل كامل أو حتّى العيش لفترة أطول (على سبيل المثال، إنسان يعيش حتّى 200 عام) من المعدّل المتوّسط، يظهر أنّ علاج الشيخوخة لا يمكن أن يتحقّق عن طريق تغيير جين واحد أو عدد قليل من الجينات. من الممكن أن تكون بعض التغييرات المرتبطة بالعمر مستقلّة إلى حدّ كبير عن عمليّة الشيخوخة، كما ذُكر في بحث آخر.
قد تكون بعض الأمراض المرتبطة بالعمر نتيجة للجينات المتأخّرة في التّفاعل. في الواقع، إذا كانت الجينات الضّارة متأخّرة/ بطيئة التّفاعل موجودة حقًّا، فمن الممكن أن تكون هناك جينات ضارّة تصيب البشر بعد أقصى عمر لنا، بعد 300 عام مثلًا. هذه يمكن أن تؤدي إلى مرض أو حتى شكل من أشكال الشيخوخة الميكانيكيّة. أطلقُ على هذه الجينات التي تكون آثارها ضارّة بعد عمرنا الأقصى الحالي اسم “الجينات القاتلة بعد الموت”. نذكر على سبيل المثال، الأمراض النّاتجة عن مستويات بروتين ذي خلل معيّن الّذي يتعدّى الحدّ الأدنى المعيّن، مثل مرض جنون البقر أو اعتلال الأعصاب النّشواني العائلي، والذي يمكن أن يكون نتيجة التراكم طويل الأمد لبروتين معيب أو عامل معدٍ بطيء المفعول. ربّما إذا تمكنّا من زيادة عمرنا الأقصى سنزيد أيضًا من عدد الأشخاص المصابين بهذا النّوع من الأمراض.
بشكلٍ عامّ، إنّ فهم آليات الشيخوخة وفكّ شفرة الجينوم سيكون من المهامّ الجسيمة. ومع ذلك، فأنا على ثقة من أنّنا، بفضل التّكنولوجيات النّاشئة، سنتمكن من توضيح جميع الآليات الجينيّة التي تدفع بالشيخوخة ضمن حياتي الخاصّة عن طريق الجمع بين المقاربات المذكورة سابقًا (الرسم التوضيحي 1 و2)، وأنا على يقين بنفس القدر من أن التوصيف المتعمق لعلم الأحياء سيكون ممكنًا في العقود القادمة، والذي سيؤدي إلى نماذج حاسوبية لجميع اللاّعبين المشاركين وتفاعلاتهم التي يمكن استخدامها بعد ذلك للتنبؤ بالتّدخلات الطبيّة. ولهذا يركز مختبري على زيادة معرفتنا بالشيخوخة على وجه الخصوص باستخدام المناهج الجينوميّة. ومع ذلك، هناك قضيّة حاسمة، وهي أنّه حتّى إذا استطعنا التنبّؤ بالجينات التي يمكن التّلاعب بها لتجنّب الشيخوخة، فسوف يتعيّن علينا أن “نأمر” خلايانا بعدم التقدّم في السّن، وهي عقبة رئيسية في رأيي. أمّا بالنّسبة لكيفيّة التّلاعب بالشّيخوخة في الجسم الحيّ فسيكون موضوع مقالتي المقبلة.
“نحن، وحدنا على وجه الأرض، يمكننا أن نثور ضدّ المستنسخين الأنانيّين.” ريتشارد دوكنز.
5. أهميّة الدّماغ في أبحاث مكافحة الشيخوخة:
شيخوخة المخ هي موضوع يجب أن أسلّط الضّوء عليه. نظريًّا، فإنّ العضو الوحيد الذي لا يمكن استبداله هو الدّماغ، وتكافئ فترة الحياة فترة الدماغ. بعد مناقشة سابقة جرت، فإنّ باب المناقشة مفتوح حول ما إذا كانت الشيخوخة ناجمة عن عوامل لا أصل لها في الدماغ. ولعلّ أدمغتنا تشيخ لأنّ الأعضاء الأخرى في الجسم لم تعد قادرة على دعمها (ولكن انظر أدناه). إذا تمكنّا من تغيير الجسم على فترات زمنيّة منتظمة لإبقائه شابًّا دائمًا، فقد يحدث أن لا يشيخ دماغنا أبدًا. لاحظ حقيقة أنّي أسميها “عمليّة زرع الجسم” وليس “الدّماغ” أو “عملية زرع الرأس” لأن الحجم هنا لا يهمّ؛ فالدّماغ هو نحن ولا يمكن تغييره أبدًا، ومع ذلك يمكن للجسم أن نغيّره، إذن، فإنّ الجسم هو المزروع. وبطبيعة الحال، فإنّ زرع الجسم تقنية صعبة وباهظة الثمن، وحتى بعيدة المنال، ولا تزال في الوقت الحاضر في عالم الخيال العلمي.
ومن الممكن أيضًا، رغم كونها جزافيةً، أن تجعل التطوّرات المستقبلية في السبرانية والأعضاء الاصطناعية والاستنساخ لأغراض علاجية- استبدال جميع الأعضاء الأخرى ممكنًا، هذا إلى جانب الدماغ. ولكن حتى لو استطعنا تطوير أعضاءٍ بديلة لأجهزتنا الحيوية، فإن هذا النّهج يبدو صعبًا وخطرًا وغير متوقّع أيضًا. تحدّد العديد من النّظريات مركز الشيخوخة في أنسجة ما بعد الانْقِسَامِ التَفَتُّلِي مثل الخلايا العصبيّة، وهكذا قد لا تكون فرضيّة إمكانية تجنّب شيخوخة الدّماغ عن طريق استبدال أو تجديد بقيّة الجسم صحيحة.
كشفت إحدى الدّراسات أن المُعمّرين (الذين بلغوا 100 سنة)، بالمقارنة مع الأشخاص المُسِنَّين غير المّعمّرين، يُظهِرون انتشارًا أقلّ للسّرطان، لكن يعانون في الواقع نسبة أعلى من انتشار الأمراض التنكّسيّة الدّماغية. في الوقت الرّاهن، يجب أن نركّز على إيجاد طريقة لوقف عملية الشّيخوخة في الجسم كله، ويكون الدمّاغ، بكلّ تأكيد، على رأس الأولويّات. رغم أنّ التّدخّل الطبيّ في الدّماغ أصعب من معظم الأعضاء، ويرجع ذلك جزئيًّا إلى الحاجز الدّموي الدّماغي؛ إلاّ أنّ هناك بعض الأسباب الّتي تبعث على التّفاؤل. على سبيل المثال، أظهرت الخلايا العصبيّة المزروعة في الفئران أنّها تعيد تشكيل الدّوائر العصبيّة المعقّدة.
إنّ فقدان الذاكرة على المدى القصير، والتغيّرات الشّخصيّة والمعرفيّة مع التقدّم في السن، والخرف، والانخفاض العامّ في الجهاز العصبي والحواسّ، والعديد من التغيّيرات الأخرى من المحتمل أن تحدث مع الشيخوخة.
كان يسري في اعتقادنا، حتّى عهد قريب، أنّ فقدان الخلايا العصبيّة بسبب تراكم الضّرر- مثل التّلف النّاتج عن الأكسدة- كان السّبب الرّئيس لشيخوخة الدّماغ. في الوقت الرّاهن، يبدو أن الخلايا العصبيّة يمكن أن تظلّ سليمة نسبيًّا خلال الحياة إلاّ في الحالات المرضيّة. بالإضافة إلى ذلك، تشير بعض الأدلّة إلى أنّ الخلايا العصبيّة يمكن أن تظهر في أدمغة البالغين، ربما يكون مصدرها الخلايا الجذعيّة العصبيّة.
تعود فكرة تنسّخ الخلايا العصبيّة إلى سنوات عديدة خلت؛ إذ أعلن جوزيف ألتمان عن تنسّخ الخلايا العصبيّة في الجرذان قبل عقود، وأعلن فرناندو نوتيبوم عن تجديد شباب الدّماغ في الطيور. وتشير بعض الأدلّة إلى أنّ الخلايا العصبيّة الجديدة يمكن أن تظهر لدى القرود البالغة في منطقة من الدّماغ تسمّى الحُصيْن (hippocampus) والّتي تخدم الذاكرة الطويلة المدى، وقد أعلن عن نتائج مماثلة على البشر.
بشكل عام، بدلًا من النّظر إلى شيخوخة الدّماغ كمجرّد نتيجة لموت الخلايا العصبيّة، يبدو أنّه حتّى بدون الموت العصبي فإنّ التغيرات البيوكيميائيّة والهيكليّة تؤثّر على وظيفة الخلايا العصبيّة . يتغيّر الإِسْلاَك ، الشّبكة المعقّدة للوصلات بين الخلايا، مع التّقدم في العمر، حتّى أنّه اقترحت فرضيّة أنّ شيخوخة الدّماغ هي امتداد لنموّ الدّماغ، تمشيًّا مع العلاقة بين التطوّر والشّيخوخة. يمتد النقاش حول ما إذا كانت الشيخوخة نتيجة تراكم الضّرر أم الأحداث المبرمجة إلى شيخوخة الدّماغ أيضًا، وعلى الرغم من أهميّة الدماغ، فإنّ لفهم آليات شيخوخته أهميّة قصوى.
إعلان
